Enerji elde etmek için organik madde alımına ihtiyaç duyduğumuz için insan ve diğer hayvanlar açık sistemlerdir. Diyetimizin% 50’si karbonhidrat,% 30’u yağ ve% 10-15’i proteinden oluşmaktadır.
Tüm bu makro besinler hidroliz yoluyla küçük biyomoleküllere ayrılır.Hücrelerin plazma zarını geçen ve mitokondriyal ortamda okside olan, yaşam için gerekli tüm dokular ve reaksiyonlar için enerji elde etmek amacıyla.
Bir yiyeceğin sindirim sisteminde vücudun özümsediği bir maddeye dönüştürüldüğü süreç olarak bilinen sindirim, gıdanın enerjiye ve metabolik ısıya dönüşmesi için gereklidir. Bunun için yiyecekler ağızdan yutulur, bir dizi mekanik ve kimyasal değişikliğe tabi tutularak mideye oradan da bağırsaklara taşınır ve son olarak da atıklar dışkı şeklinde çevreye atılır.
Bu genel süreç, gıdanın sindirim sisteminden geçişini son derece kısa bir şekilde açıklar, ancak sistemin bu bölümlerinin her birinin büyük ilgi gören bir dizi kimyasal ve fiziksel reaksiyonla karakterize edildiğine dikkat edilmelidir. Bugün size hakkında her şeyi anlatıyoruz mide düzeyinde sindirimi anlamak için gerekli olan enzimlerden biri olan pepsin.
Pepsin nedir?
Her şeyden önce, pepsin bir endopeptidaz, yani diyetle alımda elde edilen proteinleri daha küçük peptitlere parçalayan bir enzim olduğu unutulmamalıdır. Bu tür enzimatik moleküller, bir dizi çok özel yönergeyi izleyerek protein zinciri içindeki amino asitler arasındaki peptit bağlarını koparır. Pepsin, sindirimden sorumlu tek endopeptidaz değildir, çünkü diğerlerinin yanı sıra tripsin, kimotripsin, elastaz veya termolisin de bu grupta öne çıkmaktadır.
Mide ortamındaki endopeptidazların çeşitliliğine rağmen, pepsin, tripsin ve kimotripsin ile birlikte en önemlilerinden biri olarak kabul edilir.. Ek olarak, etki ortamı çok net ve sınırlandırılmıştır: midenin tam ideal koşulları olan 1.5 ve 2 pH arasında en iyi şekilde çalışır. Duodenum kısmına ulaştığında (pH 6), bu enzim inaktive olur ve işlevselliği sona erer (üç boyutlu yapısını pH 8’e kadar muhafaza etmesine rağmen).
Her durumda, tripsin, kimotripsin, elastaz ve karboksipeptidaz gibi pankreas enzimlerinin etkilerinden dolayı protein sindiriminin bağırsak seviyesinde de devam ettiğini açıklığa kavuşturmak gerekir. Bu nedenle, özüne rağmen, pepsin yaşam için gerekli değildir: Bu enzim eksikse, diğerleri protein metabolizmasını az ya da çok çabayla halledebilirler.
Merakla, Pepsinin ve diğer enzimlerin enzimatik aktivitesi, önleyici mekanizmalar yoksa vücudun kendi dokusunu kendi kendine bozabilir. açık ve etkili. Neyse ki, midenin mukus bariyeri mukus-bikarbonat benzeri bir madde salgılar, bu da mide duvarına neredeyse nötr bir pH ortamı verir ve pepsin’i etkisiz hale getirir. Midenin kendisi, göründüğü kadar mantığa aykırı olarak, içinde gerçekleşen enzimatik faaliyetten kendini korumalıdır.
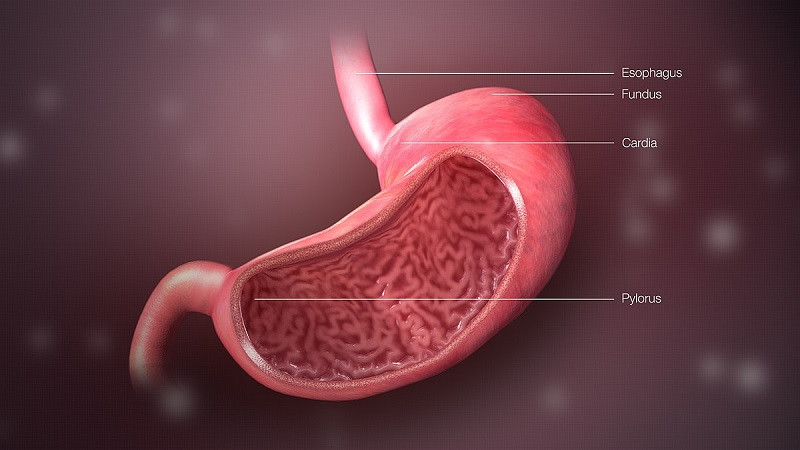
Pepsin sentezi
Pepsin, önceki satırlarda da belirttiğimiz gibi midede sentezlenir. Her neyse, mide hücreleri (mide bezlerinin ana hücreleri) kendi başına pepsin salgılar, ancak pepsinojen. Bu bileşik, gerçek enzime kıyasla 44 “ekstra” amino asit içeren inaktif bir zimojen veya proenzimdir.
Mide aparatının G hücreleri tarafından salgılanan gastrin hormonu, mide odasında çok asidik bir pH ortamı oluşturan pepsinojen ve hidroklorik asit salgılanmasını uyarır. Pepsinojen, bu asit konglomera ile temas ettiğinde, onu inaktif tutan amino asitlerin “kuyruğundan” salındığı bir otokatalitik reaksiyona girer. Böylece, mide asitlerinin varlığı sayesinde, pepsinojen, aktif varyant pepsinine dönüşür ve bu, proteinleri daha küçük moleküllere ayırmaya başlayabilir.
Ayrıca şunu belirtmek gerekir ki pepsinojen, genlerde bulunan talimatlar sayesinde sentezlenir, yani, hücrelerdeki kromozomlar. İnsanlarda, aynı pepsinojen A formunu kodlayan 3 farklı gen vardır: PGA3, PGA4 ve PGA5. Hepsi, daha sonra mide asitlerinin uyarılmasıyla enzime dönüştürülen zimojenin sentezinin yönüne sahiptir.
Diğer yandan, bazı bileşikler (pepstatin gibi) çok düşük konsantrasyonlarda pepsin inhibe edebilir. Pepstatin ilk olarak aktinomiset mantarlarının kültürlerinde izole edildi, ancak bunun hakkında bir proteaz olarak aktivitesinin ötesinde çok az şey biliniyor.
Pepsin işlevi
Bu noktada şunu vurgulamak gerekir: Pepsin kendini proteinleri parçalamaya adamıştır, ancak amino asitlerden oluştuğu için bu enzim aynı zamanda kendi başına bir proteindir.. Amino asitler, peptitlere (10 amino asitten az), polipeptitlere (10 ila 50 amino asit) ve proteinlere (50 amino asitten fazla) neden olacak şekilde peptit bağları aracılığıyla belirli sıralarda birleştirildiklerinden, herhangi bir proteinin temel birimidir. .
Pepsin, amino asitler lösin (leu) fenilalanin (phe), triptofan (trp) veya tirozin (tyr) seviyesinde parçalanacak protein zincirini, bunlardan birinden önce prolin gelmedikçe “keser”. (pro). Bunun bir endopeptidaz olduğunu hatırlıyoruz, yani “içini” kesiyor (terminal protein bölümünün parçası olmayan amino asitler arasında).
Proteinler diyetimizin yalnızca% 10-15’ini oluşturur (çünkü karbonhidratlar en zengin enerji kaynağıdır), ancak hemen hemen tüm biyolojik dokuların kuru ağırlığının% 50’sini oluştururlar, çünkü hiçbir metabolik süreç yoktur. onların yolu. Bu nedenle pepsin ve proteinleri bozan enzimlerin geri kalanı çok önemlidir: Sadece enerji elde etmek için değil, amino asitlerin kas ve deri gibi biyolojik dokulara entegrasyonu için.
Patolojilerde pepsinin rolü
İnsan vücudunun her unsuru gibi, pepsin de gerekli olmadığı zamanlarda başarısız olabilir veya faaliyetler gerçekleştirebilir, bu da patolojilere yol açar. Bu durumda, bu ve diğer enzimler önemli bir rol oynar. laringofaringeal reflü (LPR) ve gastroözofageal reflü (GERD) semptomlarının gelişimi.
Zayıflamış özofagus sfinkteri (LES) olan bir kişi bu durumları yaşayabilir, çünkü mide suları ile karıştırılan yiyecek bolusu, midenin ortamı iyi tanımlanmamışsa yemek borusuna geri döner. Bu, asitlerin, pepsinlerin ve diğer enzimlerin özofagus tüpünden geri gitmesine, hatta gırtlağa ve en kötü durumda akciğer ortamına ulaşmasına neden olur.
Konuları daha da karmaşık hale getirmek için, LPR hastaları lokal nöral duyarlılığı değiştirmişlerdir, bu nedenle laringeal ortamda asit varlığına öksürük ve raller ile yanıt veremezler. Aktif halde olması ve vücuttan atılmaması, pepsin, laringeal dokuları parçalamaya başlar, bu da kronik disfaji (yutma güçlüğü), sert bir ses ve tekrarlayan öksürüklerle sonuçlanır.. Pepsin laringeal ortamla ne kadar çok temas halinde olursa, hasar o kadar kötüdür.
Devam et
Gördüğünüz gibi, pepsin, midenin asidik ortamı ile kendi kendini aktive ettiği ve işlevselliği tamamen çevresel pH’a bağlı olarak düzenlendiği için fizyolojik düzeyde çok ilginç bir enzimdir. PH 1.5 ile 2 arasında tutulursa enzim aktif formunda kalır ve görevini yerine getirir. Bu değer değiştiğinde üç boyutlu yapısını korur ancak midede olduğu gibi proteinleri parçalamaz.
Pepsin ve enzimatik yapıdaki diğer birçok biyomolekül sayesinde insan, tükettiğimiz proteinleri enerjiye ve hepsinden önemlisi doku oluşumu ve onarımı için yararlı amino asitlere dönüştürebilir. Elbette, iç metabolizmamız olmadan hiçbir şey olmadığımız bizim için açıktır.
Bibliyografik referanslar:
- Umezawa, H., AOYAGI, T., MORISHIMA, H., MATSUZAKI, M., HAMADA, M., & TAKEUCHI, T. (1970). Agtinomiygetler tarafından üretilen yeni bir pepsin inhibitörü olan pepstatin. Antibiyotik Dergisi, 23 (5), 259-262.
- Rajagopalan, TG, Moore, S. ve Stein, WH (1966). Pepsinojenden pepsin: Hazırlama ve özellikleri. Biyolojik Kimya Dergisi, 241 (21), 4940-4950.
- Ly, J., Almaguel, R., Delgado, E., Carón, M. ve Cruz, E. (2010). Domuzları beslemek için manyok köklerinin in vitro sindirilebilirlik çalışmaları (pepsin / pankreatin) ”. Bilgisayarlı Domuz Üretim Dergisi, 17 (4).
- Heda, R. ve Tombazzi, CR (2018). Fizyoloji, Pepsin. StatPearls [Internet].
- Brown, J. ve Shermetaro, C. (2021). Laringofaringeal reflü. StatPearls [Internet].
- Bernal, JD ve Crowfoot, D. (1934). Kristalin pepsinin X-ışını fotoğrafları. Nature, 133 (3369), 794-795.
- Bajwa, SA, Toro, F. ve Kasi, A. (2020). Fizyoloji, Yemek borusu. StatPearls [Internet].
- Akeson, WR ve Stahmann, MA (1964). Protein kalite değerlendirmesinin bir pepsin pankreatin sindirim indeksi. Beslenme Dergisi, 83 (3), 257-261.

 Kromozomun 6 bölümü: özellikleri ve işlevleri
Kromozomun 6 bölümü: özellikleri ve işlevleri
 Kromozomlar nedir ve nasıl çalışır?
Kromozomlar nedir ve nasıl çalışır?
 HIV, İnsan Davranışını Değiştirebilir mi?
HIV, İnsan Davranışını Değiştirebilir mi?
 Maslow’un İhtiyaç Piramidi nedir?
Maslow’un İhtiyaç Piramidi nedir?
 Eklem nedir, türleri ve anatomik özellikleri
Eklem nedir, türleri ve anatomik özellikleri
 Bilişsel rehabilitasyon nedir ve hastalara nasıl yardımcı olur
Bilişsel rehabilitasyon nedir ve hastalara nasıl yardımcı olur
 Omurga vücutta nedir, türleri ve işlevleri
Omurga vücutta nedir, türleri ve işlevleri
